
Staklo je amorfna materija koja nastaje hlađenjem rastopa bez kristalizacije. S obzirom na svoj sastav poznata su i druga stakla (npr. metalna, organska). U užem smislu pod staklom se podrazumeva samo proziran materijal koji nastaje u prvom redu od anorganskih silikatnih rastopa, pa se tako opisuje i u ovom radu.
Staklo je veštački proizvod i nalazi se u prirodi. Poznato je od davnina da je staklo zbog svojih izvanrednih i jedinstvenih osobina nezamenljiv materijal u svakodnevnom životu, tehničkoj praksi, industriji, građevinarstvu, nauci i umetnosti.
U XVIII veku staklarski proizvodi već su u širokoj upotrebi, a na dalji razvoj bitno je uticalo uvođenje postupka za veštačko dobijanje sode, jednog od osnovnih sirovinskih sastojaka u proizvodnji stakla. U drugoj polovini XIX veka napravljen je veliki napredak u proizvodnji koji omogućuje primena Simensovog regenerativnog sistema u loženju staklarskih peći. Intenzivan razvoj mašinske proizvodnje i prerade stakla počinje na prelazu vekova. Godine 1903. u eksperimentu je u pogonu Ovensova mašina za duvanje stakla. Istog je ranga važnosti i Faircaultova konstrukcija mašine za izvlačenje ravnog stakla. Nakon Prvog svetskog rata u zametku je mašinska prerada staklenog rastopa, a 1925. u pogonu su kompletna usavršena industrijska postrojenja za masovnu proizvodnju ravnog stakla, staklenih cevi i šupljih staklenih predmeta (boce, čaše, baloni za sijalice). Približno u isto vreme, oko 1930., staklo se potvrđuje i kao važan građevinski materijal.
Staklo je u normalnim uslovima u čvrstom stanju. Za razliku od sređenog (kristalnog čvrstog stanja), staklo je, s obzirom na prostor ravnotežnih položaja atoma, tipičan predstavnik nesređenog (amorfno) čvrstog stanja. U amorfnim materijama i tečnostima sređen je samo tzv. bliski poredak, tj opaža se sređenost atoma samo na malim međusobnim udaljenostima (reda veličine srednjih međuatomskih rastojanja).
Amorfne materije su slične tečnostima i bitno se razlikuju od kristalnih, gde su atomi i u dalekom poretku potpuno sređeni, pogledati sliku 1.
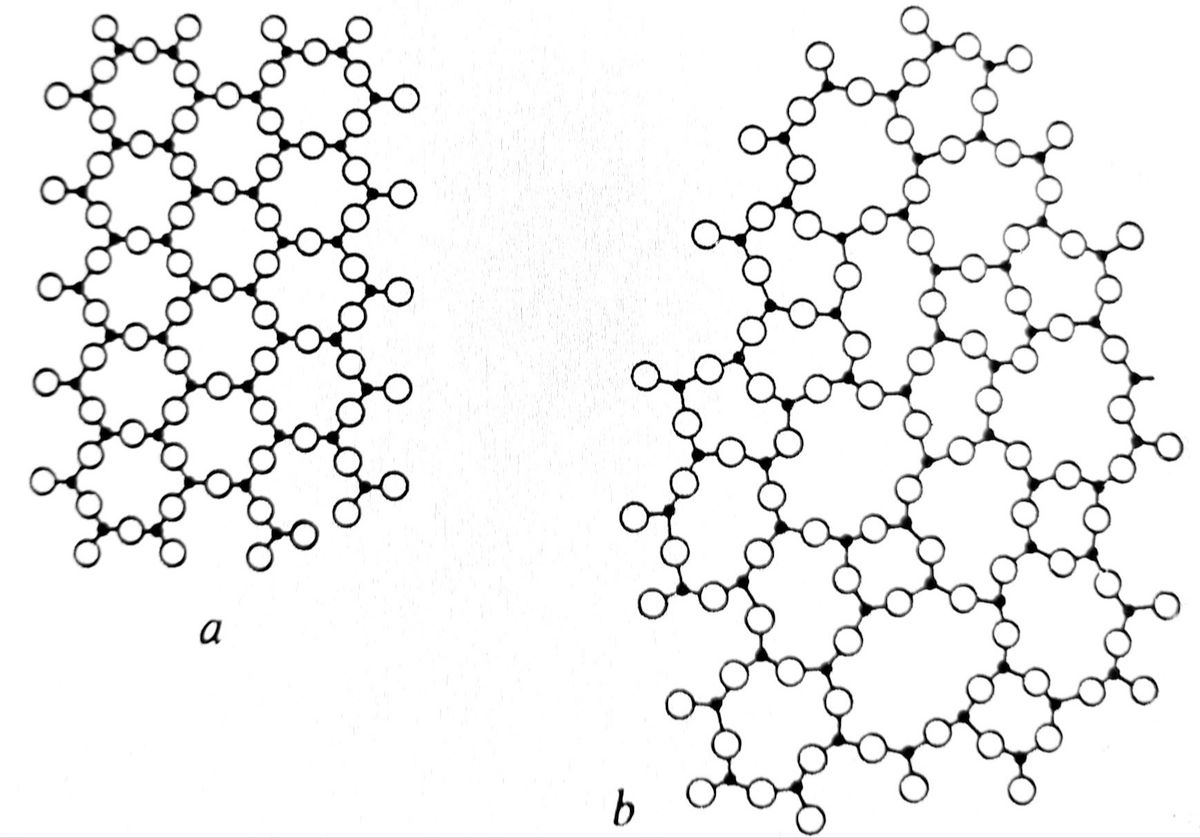
Za razliku od ostalih amorfnih materija koje mogu nastati direktno od kristala, te taloženjem iz rastopa ili od svojih para, staklom se smatraju one amorfne čvrste materije koje nastaju pothlađivanjem rastopa, odnosno tečnosti. One se u normalnim uslovima nalaze u staklenom stanju.Nastajanje staklenog stanja može se dobro uočiti praćenjem promene specifične zapremine (ili neke druge osobine, npr entalpije, rastegljivosti, indeksa loma) prilikom hlađenja bilo kojeg rastopa, pogledati sliku 2.
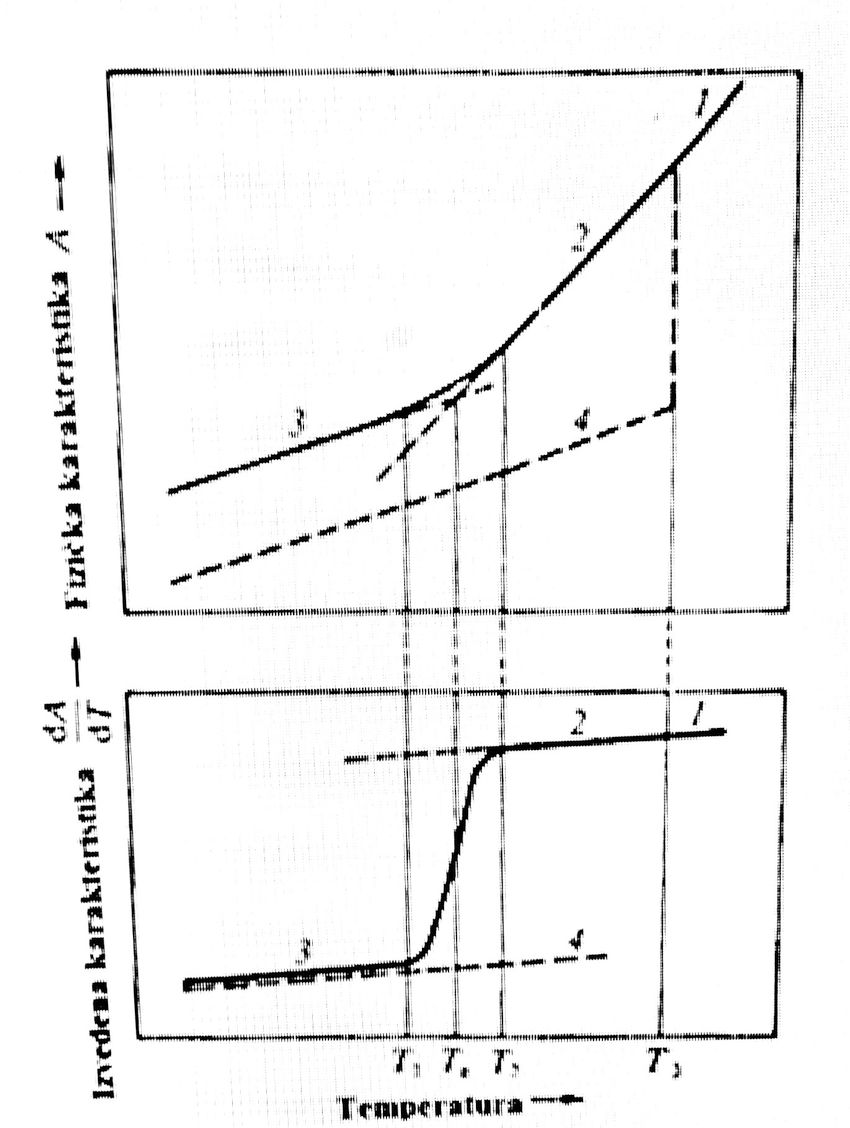
Opadanjem temperature zapremina rastopa se smanjuje, da bi na temperaturi koja odgovara topljenju, rastop prešao u kristalno stanje koje je termodinamički stabilnije od amorfnog. Ako taj prelaz zbog nekog razloga nije moguć, npr. zbog prebrzog hlađenja, kristalizacija izostaje. Opadanjem temperature viskozitet rastopa raste. Daljim hlađenjem nekristalisanog rastopa, koji se na temperaturama nižim od temperature kristalizacije naziva pothlađeni, njegova zapremina se i dalje menja linearno sa temperaturom, pogledati sliku 2.
Kada viskozitet postane toliki da značajno ograniči kretanje atoma, osobine pothlađenog rastopa počinju bitno da se menjaju. Rastop više nije potpuno tečan, ali je još mekan i plastičan pa se dobro oblikuje duvanjem, presovanjem, valjanjem i izvlačenjem. Otvrdnjavanje, odnosno omekšavanje, nije promena u uređenosti stanja, nego je posledica kontinuirane promene viskoziteta, pa se ne događa na nekoj određenoj temperaturi, nego u širem temperaturnom području (područje transformacije). Na nekoj nižoj temperaturi kretanje atoma postaje potpuno ograničeno, pa se fiksira trenutno zatečena konfiguracija pothlađenog rastopa.
Ona tada potpuno očvršćuje, prelazi u čvrstu fazu i postaje staklo, kome se osobine daljim hlađenjem opet menjaju linearno. Širina područja transformacije zavisi od sastava rastopa i brzine hlađenja. Tu je područje karakterisano temperaturom transformacije, Tg.
Opisana promena je reverzibilna, tj. staklu se zagrevanjem postepeno smanjuje viskozitet, pa ono omekšava, postaje plastično, a zatim prelazi u rastop.
U područje transformacije za uspostavljanje nove ravnoteže nakon svake temperaturne promene potrebno je neko konačno vreme (vreme relaksacije koje se smanjivanjem temperature i povećanjem viskoziteta produžava). Tako npr. za rastop viskoziteta 1012 Pas vreme relaksacije je reda veličine nekoliko minuta. Uspostavljanje ravnoteže sve više zaostaje za temperaturom, tj. na svakoj se temperaturi uspostavlja ravnoteža koja odgovara onoj ranijoj višoj temperaturi, sve dok se u čvrstom staklu ta ravnoteža u konačnom vremenu više ne može uspostaviti.
Hemijski sastav i struktura stakla
Staklo je po svom hemijskom sastavu anorganske oksidne prirode. Ono se sastoji od oksida elemenata, koji su u obliku različitih spojeva, uglavnom karbonatnih oksidnih, pravili su sirovinsku smesu za topljenje. U čvrstom staklu ti su elementi u obliku jona povezani u nepravilnu (nekristaliziranu, amorfnu) prostorno umreženu strukturu. Za stvaranje stakla prikladni oksidi kojima je koordinacijski broj katjona mali (< 6) i koji povezivanjem svojih atoma mogu praviti male poliedre kao osnovne strukturne jedinice. Osim toga njihov anjon (O2–) sme biti povezan sa najviše 2 središnja atoma poliedra tako da pravi mostove među poliedrima, po dva poliedra ne mogu imati više od jednog zajedničkog ugla. Ta pravila zadovoljavaju, u prvom redu, elemente silicijum, bor, fosfor, germanijum i arsen. Oni u staklu mogu praviti trodimenzionalnu strukturnu mrežu, pa se nazivaju mrežotvorcima. Najvažniji je od njih silicijum. U SiO2 staklu (kvarcnom ili kvarcnom staklu), u staklu koje ne sadrži druge sastojke osim SiO2, svaki je atom kiseonika povezan sa 2 silicijumova atoma. Povezivanje u staklu je potpuno nepravilno i nesređeno, pogledati sliku 3.
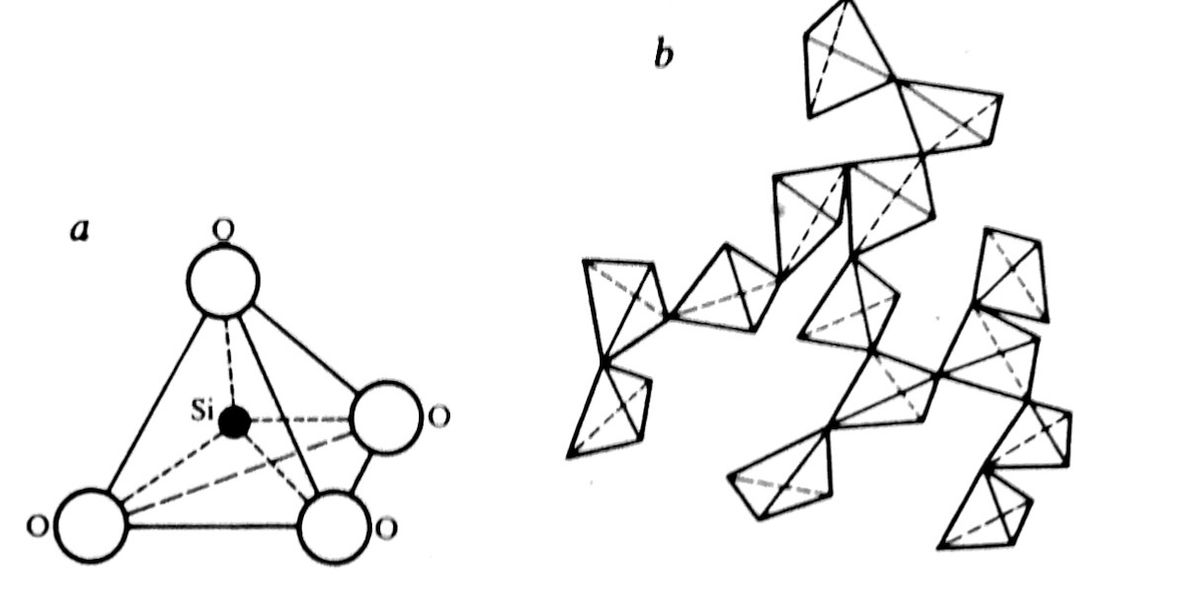
Tetraedri su povezani jakim hemijskim vezama, pa je SiO2 – staklo čvrsto, tvrdo i teško topljivo, te se na uobičajenim radnim temperaturama vrlo teško prerađuje. Njegov viskozitet i na temperaturama višim od topljenja je tako velik da je isterivanje mehurića vazduha iz rastopa praktično nemoguće. Zbog toga staklo sadrži i modifikatore mreže, a to su oksidi alkalnih i zemnoalkalnih metala. Alkalni oksidi u prvom redu oksidi natrijuma i kalijuma treba da oslabe čvrstu tetraedarsku strukturu SiO2 – staklo i tako omoguće njegovu lakšu preradu. To se postiže tako da se dodatni atomi kiseonika iz tih oksida ugrađuju mestimično u strukturu mreža i kidaju veze Si–O–Si, a metalni katjoni smeštaju u nastale slobodne prostore, pogledati sliku 4.
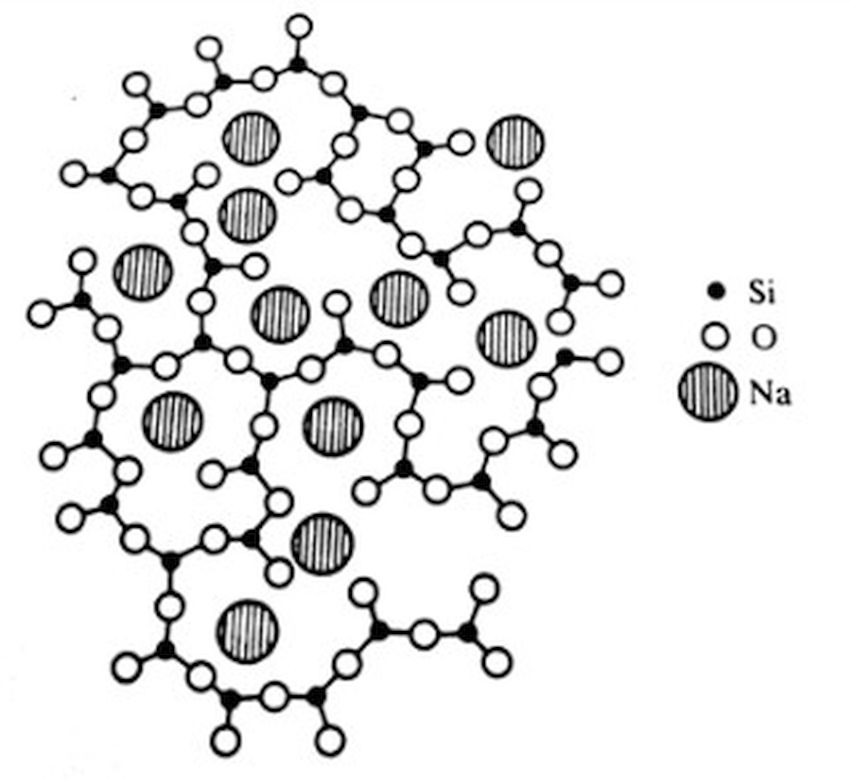
Stakla moraju sadržavati i druge modifikatore koji deluju stabilizaciono. To su modifikator oksidi zemnoalkalnih metala, kalcijum-oksid, CaO i magnezijum oksid MgO, a ponekad i barijum-oksid, BaO. Stakla se uopšteno klasifikuju i nazivaju prema hemijskom sastavu ili prema nameni, a mnoge poznate vrste stakla nose i posebna trgovačka imena. Za silikatna stakla hemijski naziv se odnosi na onaj oksid koji je, osim slicijum-dioksid, kao osnovne komponente, u njima karakterističan ili najviše zastupljen. Glavne vrste silikatnih stakala natrijumsko-kalcijumsko (natrijumsko), kalijsko-kalcijumsko (kalijsko), olovno, borosilikatno i alumosilikatno staklo. Natrijumsko-kalcijumsko staklo kao glavne okside sadrže Na2O3, CaO i SiO2 u približnom molnom omeru 1 : 1 : 6, a u tom se omeru nalaze oksidi K2O3 i CaO i SiO2 u kalijumsko kalcijevskom staklu. Olovno staklo nastaje zamenom oksida CaO iz kalijumsko-kalcijumskog stakla olovnim oksidom, PbO. U borosilikatnim i alumino-silikatnim staklima deo SiO2 je zamenjen bor-oksidom, B2O3, ili aluminijum-oksidom Al2O3 dok je udeo ostalih oksida uglavnom mnogo manji.
Osobine stakla
Fizičke i hemijske osobine stakla najviše zavise od hemijskog sastava. Hemijski sastav stakla rezultuje iz vrste i količine upotrebljivih sirovima, to će i osobine stakla biti u direktnoj vezi sa sirovinama, oksidima.
Egzaktno izračunavanje numeričkih vrednosti pojedinih osobina stakla iz njegovog oksidnog sastava nije moguće. Međutim, vrednosti nekih osobina mogu se ipak približno izračunati na osnovu aditivnih osobina pojedinih komponenti. To vredi za gustinu, specifični toplotni kapacitet, toplotnu provodljivost, koeficijent toplotnog širenja, dielektričnu konstantu i indeks loma, dok viskozitet, hemijska otpornost, električna provodljivost i čvrstoća ne mogu se utvrditi na osnovu sirovinskog sastava, ni približno proceniti.
Viskozitet
Viskozitet je jedna od najvažnijih osobina kompletne staklarske tehnike. Viskozitet je vrlo bitan u svim procesima mešanja, bistrenja, livenja, presovanja, izvlačenja i duvanja u daljoj preradi stakla pri nastajanju klica i kristalizacije, te u svim procesima stvaranja mikrostruktura. Viskozitet stakla, odnosno staklenog rastopa kontinuirano raste sa opadanjem temperature, pogledati sliku 5.
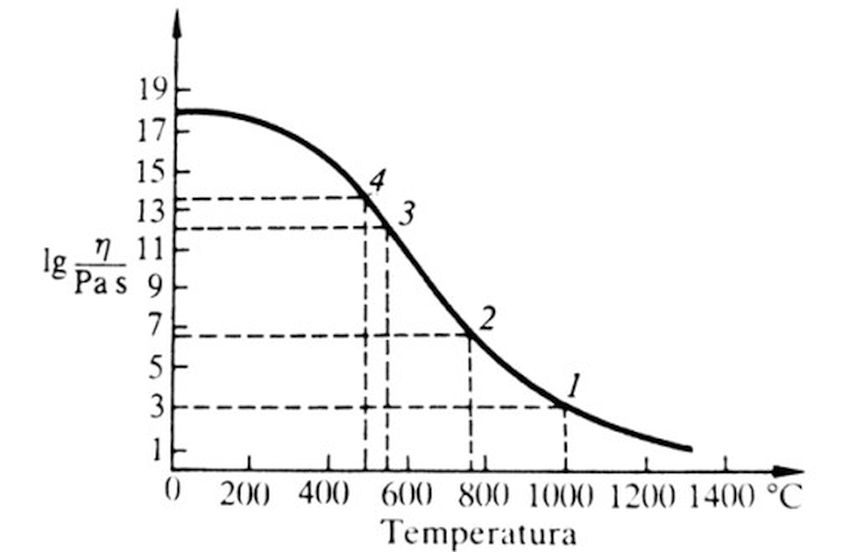
Položaj krive koja u dijagramu pokazuje tu zavisnost uslovljen je vrstom stakla. Zavisnost viskoziteta od hemijskog sastava stakla svodi se na odlučujući uticaj umreženosti strukture. Potpuno homogeni stakleni rastop u tečnom stanju pokazuje dinamički viskozitet od najviše 10 Pas, (pogledati sliku 5). U području viskoziteta 103 Pas do 106 Pas staklo je mekano i plastično, pa se u tom području prerađuje i oblikuje. Sledeća markantna tačka nalazi se pri viskoziteta 106,6 Pas. Područje transformacije u kome staklo hlađenjem potpuno očvrsne, ograničeno je gornjom tačkom hlađenja (viskozitet 1012 Pas) i donjom tačkom hlađenja (viskozitet 1013,5 Pas).
Gustina stakla
Gustina većine tehničkih stakala iznosi ~ 2,5 g/cm3. Gustina stakla kao aditivno svojstvo izrazito zavisi od sastava i može se pomoću njega dosta tačno izračunati, pa zato za različita stakla može varirati u širokim granicama, od 2–6 g/cm3. Najlakša su borosilikatna stakla, a najteža ona sa velikim udelom oksida teških metala, naročito olovnog oksida.
Mehaničke osobine
Čvrstoća stakla zavisi od njegovog sastava. Pritisna čvrstoća je relativno visoka ali je zatezna čvrstoća dosta mala ( 50–140 N/mm2) i izrazito je zavisna od stanja površine stakla, tj.od stepena oštećenosti. Prilikom mehaničkog opterećenja staklo se ne omekšava i plastično se ne deformiše kao metal. Naprezanja nastala pritiskom ili zateznim mehaničkim opterećenjem privremeno i potpuno nestaju nakon prestanka delovanja opterećenja. Dopuštena naprezanja u staklenim proizvodima zavise od oblika proizvoda, njihove namene i uslovima izrade.
Tvrdoća
Tvrdoća nekih industrijskih stakala dosta je velika, a uopšteno iznosi 4,5 do 7,5 na Mohsovoj skali. Staklo je u čvrstom stanju plastično. Modul elastičnosti SiO2 stakla iznosi 70 · 103 N/mm2, a menja se dodatkom ostalih komponenata. Posebno je visok modul elastičnosti alumo silikatnih stakala.
Toplotne osobine
Specifični toplotni kapacitet stakla zavisi od sastava, i u temperaturnom području 20 – 100 °C relativno malo varira. Njegova je prosečna vrednost za većinu tehničkih stakala ~ 0,8 J g–1 K–1 na sobnoj temperaturi, dok sa povišenjem temperature raste. Toplotna provodljivost stakla takođe zavisi od sastava, a raste sa porastom temeperature. Na sobnoj temperaturi toplotna provodljivost većine stakala ~ 0,84 W m–1 K–1. Najveću toplotnu provodljivost na toj temperaturi ima SiO2 staklo (1,38 W m–1 K–1) a najmanju olovno staklo (0,71 W m–1 K–1).
Toplotno širenje
Od toplotnih osobina stakla najvažnije je njegovo toplotno širenje, jer je poznavanje ponašanja stakla pri promeni temperature bitno pri preradi, za određivanje režima hlađenja, očvršćavanja sa drugim vrstama stakla i drugim materijalima. Staklo se sa porastom temperature rasteže linearno sve do područja transformacije.
Slično kao i viskozitet, toplotno izduženje je funkcija umreženosti strukture. Razumljivo je da je izduženje manje što je umreženost veća. Toplotno izduženje se može dosta tačno izračunati na osnovu poznavanja osobina stakla. Za većinu stakala u temperaturnom intervalu 20 do 300 °C izmereni su koeficijenti linearnog toplotnog izduženja između 30·10–7 K–1 (kvalitetno laboratorijsko staklo) i 90·10–7 K–1 (obično prozorsko staklo). Vrlo se malo isteže SiO2 staklo [koeficijent (5 – 6) ·10–7 K–1 ].
Električne osobine
Za staklo je od električnih osobina najvažnija električna provodljivost, jer o tome zavisi mogućnost njegove upotrebe u elektrotehnici, a takođe i mogućnost topljenja novim postupcima, npr. otpornim zagrevanjem. Obično su stakla na sobnoj temperaturi u suvoj atmosferi dobri izolatori (električna provodljivost 10–11 … 10–19 Scm–1). Povećavanjem temperature električna provodljivost brzo raste. Njena je zavisnost od sastava stakla lako uočljiva, jer zavisi u prvom redu od vodljivosti katjona. Na sobnoj temperaturi su najpokretljiviji alkalni katjoni, posebno natrijumovi, dok na višim temperaturama u provođenju struje sudeluju katjoni većeg naboja.
Dielektrična konstanta takođe zavisi od sastava stakla i povećava se sa povišenjem temperature. Njene su vrednosti za obično prozorsko staklo 6,5 do 8, za SiO2 staklo 3,75, a za teško staklo sa mnogo olovnog oksida oko 15 i više.
Optičke osobine
Predstava o staklu kao materijalu vezana je u prvom redu sa njegovom prozirnošću. Obično i jednostavno silikatno staklo bez primesa, staklo koje osim SiO2 sadrži samo neophodne okside alkalnih i zemnoalkalnih metala, vrlo slabo apsorbuje elektromagnetno zračenje u vidljivom delu spektra, pa u prolaznoj svetlosti deluje bezbojno. Ono je nepropusno za ultraljubičasto i infracrveno zračenje, a samo čisto SiO2 staklo propušta infracrveno zračenje u nekim granicama.
Staklo se razlikuje od skoro svih ostalih materijala, sposobnošću da propušta zrake vidljive svetlosti pa je to i osnova njegove široke primene i nezameljivosti u svakodnevnom životu i u najrazličitijim oblicima ljudske delatnosti.
Prozirnost stakla i promena brzine putovanja svetlosti pri prolazu kroz staklo uzrok su opažanja niza karakterističnih optičkih osobina: prozirnosti, refleksije, apsorpcije, loma i disperzije. Te su osobine u uskoj vezi sa sastavom stakla i neka se od njih mogu sa približnom tačnošću izračunati na osnovu poznavanja tog sastava.
Svetlost se od stakla delimično reflektuje, delimično se u njemu apsorbuje, a preostali deo svetlosti kroz staklo prolazi, izlazi, pogledati sliku 6.
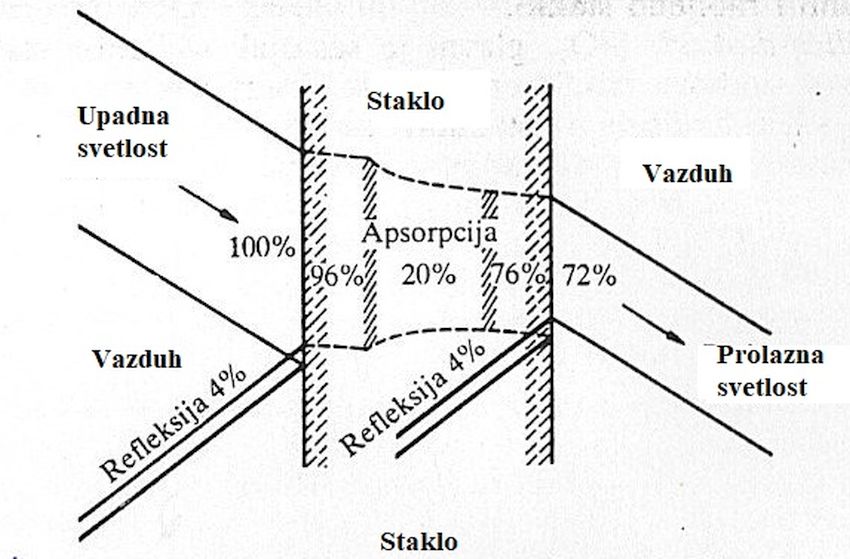
Od svake površine nekog uzorka običnog natrijumsko-kalcijumskog stakla reflektuje se priližno 4 % od ukupne količine upadne svetlosti, dok je apsorpcija u kvalitetnom, neobojenom optičkom staklu veoma mala. Obojenost stakla je rezultat prisutnosti primesa koje propuštaju samo svetlost određenog spektralnog produčja, a ostalu apsorbuju.
Lom svetlosti
Lom svetlosti karakteristična je veličina mnogih za svetlost propusnih medija i može se vrlo tačno odrediti.
Hemijske osobine
Hemijska postojanost je vrlo važna osobina stakla. Uopšteno je otpornost kvalitetnog stakla prema vodi, kiselinama i bazama dobra, ali je veoma zavisna od sastava stakla i o delujućem mediju, i bitno se pogoršava sa povišenjem temperature. Delovanje većine kiselina na silikatna stakla manifestuje se u izmeni katjona iz stakla, pre svega alkalnih, sa vodonikovim jonima. Strukturno umreženje ostaje sačuvano, a na površini se stvara tanak sloj gela koji štiti stakla od daljeg razaranja. Silikatna stakla su neotporna jedino prema fluorovodoničnoj kiselini i koncentrisanoj fosfornoj kiselini, u kojima se otapaju razgradnjom svoje umrežene strukture.
Silikatna stakla su mnogo osetljivija prema delovanju baza. Jake baze napadaju i razgrađuju umreženu strukturu stakla, kidanjem veza Si–O–Si, taj proces vremenom stalno napreduje. Delovanje vode, uključujući i atmosferilije, kombinacija je delovanja kiselina i baza, slabije.
Zamenom alkalnih metala u staklu, viševalentnim metalima značajno se poboljšava hemijska otpornost stakla. Zato su prema hemijskim uticajima otpornija stakla sa većim udelom CaO, MgO, Al2O3, B2O3 i sl. tako su osim SiO2 stakla, prema kiselinama veoma otporna borosilikatna i alumosilikatna stakla, a prema bazama su posebno postojana stakla koja sadrže cirkonijum-oksid, ZrO2.

Sirovine za proizvodnju stakla
Prema proizvodnoj tehnologiji i željenim osobinama budućeg staklenog proizvoda izabiraju se potrebne sirovine za sirovinsku smesu koja će topljenjem dati homogenu topljevinu. Sirovine za proizvodnju stakla svrstavaju se u osnovne, koje ulaze u konstituciju stakla i nosioci su mrežotvornih, modifikacionih i intermedijarnih katjona, a pomoćne sirovine su sredstva za bojenje, uklanjanje boje, bistrenje, homogenizovanje, zamućivanje, pospešivanje topljenja itd. Često neka sirovina ima i višestruku ulogu, a mnogo je i specifičnih, retko upotrebljavanih sirovina koje su nosioci nekih posebnih osobina i služe samo u proizvodnji specijalnih vrsta stakala, u prvom redu optičkih, ali i takvih koja su, npr. posebno nepropusna za elektromagnetne talase malih talasnih dužina, apsorbujući termičke neutrone i sl. U masovnoj proizvodnji običnog stakla najčešće se upotrebljava mnogo manji broj sirovina, u šta treba ubrojiti i otpadno i korišćeno staklo.
Silicijum-dioksid, SiO2
Silicijum-dioksid, SiO2 je glavni sastojak silikatnih stakala jer pravi njihovu trodimenzionu strukturnu mrežu. Maseni udeo silicijum-dioksida u staklima iznosi između 55-80 %. Sa povećavanjem njegovog udela povećava se i temperatura topljenja, prerade i transformacije, te viskozitet, mehanička čvrstoća, hemijska otpornost i težnja ka kristalizaciji, a smanjuje se gustina, toplotno istezanje, vodljivost, električna provodljivost, indeks loma i apsorpcija ultraljubičastih zraka. Kao glavni izvor silicijum-dioksida služi kvarscni pesak. Najoštrijim zahtevima podleže kvarcni pesak za proizvodnju raznovrsnog bezbojnog stakla. Takav pesak ne sme sadržavati primese koje staklu daju boju, a to su oksidi željeza, hroma, i titana. U kvalitetnom kvarcnom pesku maseni udeo SiO2 mora biti veći od 98 %, a udeo Fe2O3 ne sme biti veći od 0,05 %.
Bar oksid B2O3
Bar oksid B2O3 je važna komponenta stakla, naročito specijalnih stakala. Bor (III)-oksid može u staklu znatno zameniti silicijum-oksid, jer atomi bora takođe mogu biti umreženi, kao i atomi silicijuma. Mogu izgrađivati osnovnu trodimenzionu strukturnu mrežu stakla.
Dodavanjem B2O5 poboljšavaju se i neke optičke osobine. Tako se, npr., povećava sjaj i propusnost svetlosti u dugotalasnom spektralnom području, a smanjuje u kratkotalasnom.
Fosforni oksid P2O5
Fosfor oksid P2O5, može kao i B2O5 biti mrežotvoran oksid i u potpunosti zamenjuje SiO2 u strukturnoj mreži stakla. Postoje čista, bezbojna fosfatna stakla bez SiO2, koja se ističu velikom propustljivošću elektromagnetnog zračenja u infracrvenom spektralnom području, ali slabom hemijskom otpornošću. Za proizvodnju mutnih stakala najviše se upotrebljavaju kalcijumovi i natrijumovi fosfati ili fosfatne kiseline.
Oksidi alkalnih metala
Oksidi alkalnih metala, u prvom redu oksidi natrijuma i kalijuma, sastavni su deo skoro svakog stakla, a njihovo delovanje je kao modifikator mreže. Natrijum-oksid, Na2O3, delotvorniji je u svojoj osnovnoj funkciji, u snižavanju viskoziteta i omogućavanju lakšeg topljenja i prerade stakla. Kalijum oksid K2O, ima drugih prednosti. Stakla sa više K2O otpornija su na temperaturne promene, glađe su površine, lakše se obezboje i mogu se lepše obojiti, a sjajnije su zbog većeg loma svetlosti. Kao sirovina za unošenje kalijum-oksida u smesu za topljenje stakla, skoro jedino služi kalijum-karbonat, K2CO3.
Litijum oksid
Litijum oksid, Li2O, ređi je sastojak stakla koji povećava lom svetlosti, tvrdoću i otpornost prema kiselinama i bazama, a smanjuje viskozitet i linearno toplotno izduženje.

Oksidi zemnoalkalnih metala
Oksidi zemnoalkalnih metala su oksidi kalcijuma, magnezijuma i barija, strukturni su modifikatori stakla. Uloga je kalcijum-oksida CaO, da u prvom redu doprinese otpornosti alkalno-silikatnih stakala prema vodi, kiselinama i bazama, i tako ih učini tehnički upotrebljivijim. Oksidi kalcijuma, magnezijuma i barijuma utiču na druge osobine stakla, pa se često dodaje zajedno u različitim međusobnim omerima. Od tih oksida kalcijum-oksid najviše povećava zateznu i čvrstoću na savijanje stakla, njegov modul elastičnosti i otpornost na temperaturne promene. Magnezijum-oksid najviše među oksidima potiskuje tendenciju stakla prema kristalizaciji, povećava gustinu. Glavne sirovine za unošenje opisanih oksida u stakleni rastop su njihovi karbonati.
Aluminijum-oksid Al2O3
Aluminijum-oksid, Al2O3, kao sastojak stakla intermedijarni je oksid koji sa udelom od 1 % poboljšava većinu osobina stakla, u kome zamenjuje oksid alkalnog metala. Sa udelom do 4 %, povećava udarnu, zateznu i pritisnu čvrstoću te hemijsku otpornost, a smanjuje toplotno izduženje i težnju prema kristalizaciji. Sirovine kojima se aluminjim-oksid unosi u smesu za topljenje stakla uglavnom su prirodni aluminijumski minerali i stene. U poslednje vreme se za te svrhe sve više upotrebljava i troska visokih peći, iz koje se prvo magnetski uklanja željezo.
Olovni oksid PbO
Olovni oksid PbO, dodaje se u sirovinsku smesu poznat pod trgovačkim imenom minij i sa formulom Pb3O4. Olovni oksid deluje u staklu slično kao i oksidi alkalnih metala, pa ih u nekim vrstama stakla može skoro potpuno zameniti. Stakla bogata olovom odlikuju se velikom gustinom. Najvažnije je što olovni-oksid najviše od svih oksidnih komponenata stakla povećava lom svetlosti, pa se takvi proizvodi upotrebljavaju kao veoma kvalitetna stakla u optičke svrhe.
Cink-oksid ZnO
Cink-oksid, ZnO se dodaje staklu, u prvom redu zbog poboljšavanja otpornosti prema temperaturnim promenama. Osim toga, cink-oksid poboljšava postojanost stakla prema vodi i kiselinama, ali smanjuje otpornost prema bazama. Takva stakla jače lome svetlost, ali im je loša strana što su sklona kristalizaciji. Kao sirovina sa cinkom u staklarskoj se industriji upotrebljava tehnički proizveden čisti cink-oksid.
Sredstva za obezbojavanje
Ako se u proizvodnji stakla pretežno upotrebljavaju prirodne, dakle ne sasvim čiste sirovine, što je uslov za proizvodnju jeftinog stakla, stakleni će proizvodi često biti manje ili više obojeni. Boja stakla potiče od različitih metalnih oksida koji se u staklo unose sa sirovinama ili dospevaju u rastop, u toku proizvodnog procesa trošenjem vatrostalnog materijala peći, delova aparatura, iz goriva i sl. boja često potiče od oksida nikla, vanadijuma, bakra, mangana i hroma, ali je u prvom redu uzrokovana prisutnošću oksida željeza. Joni željeza u dvovalentnom obliku (Fe2+) daju staklu zelenu boju, koja je deset puta intenzivnija od smeđe boje trovalentnog jona (Fe3+). Najčešće se hemijska metoda obezbojavanja mora kombinovati sa fizičkom. Staklu se tada B2O3 stakla se kompenzuje optički.
Sredstva za bojenje
Jednostavno i čisto alkalno silikatno staklo bez primesa drugih metalnih jona prozirno je i bezbojno. Ono se u čitavoj staklenoj masi može učiniti obojenim dodavanjem različitih oksida u sirovinsku smesu pre topljenja. Dodaju se u prvom redu oksidi teških metala, čiji katjoni apsorbuju svetlost u nekom delu vidljivog spektralnog područja. Boja će, naravno, zavisiti od koncentracije katjona, a donekle i od uticaja drugih jona u osnovnoj strukturi stakla.
Nastavak ovog teksta možete pročitati na LINKU
Autori teksta: Prof. dr D. Škobalj, Ž. Đokić, dipl.ing.















